Pleurasygdomme

Katrine Fjællegaard1, 2, Jesper Koefod Petersen1, 2, Casper Jensen1, Daniel Bech Rasmussen1, 3, Søren Helbo Skaarup4, Christian B. Laursen5, 6 & Uffe Bødtger1, 3
Hovedbudskaber
Pleurasygdomme omfatter the big four: pleuramalignitet, nonmalign pleuraeffusion, pleurainfektion og pneumothorax [1]. Hyppigheden af pleurasygdomme er stigende med en aktuel incidens på ca. 360/100.000, dvs. lidt over 20.000 nye tilfælde årligt i Danmark [2]. Den stigende incidens ses primært inden for pleuramalignitet og nonmalign pleuraeffusion grundet stigende middellevetid og øget overlevelse af f.eks. cancer og kronisk hjerte- eller nyresvigt [2]. Inden for de seneste år er håndtering af pleurasygdom blevet tiltagende evidensbaseret på grund af et stort antal RCT’er, som har medført betydeligt reviderede udgaver af de internationalt anerkendte pleuraguidelines fra British Thoracic Society (BTS) og European Respiratory Society (ERS) [1, 3]. Dansk Lungemedicinsk Selskabs (DLS) retningslinjer opdateres løbende og følger generelt BTS’ og ERS’ guidelines [4].
I denne statusartikel vil vi opsummere moderne udredning og behandling af the big four. Fælles for alle er:
1) At behandling er individualiseret ud fra fænotype og patientønsker med fokus på tidlig intervention.
2) At læger/afdelinger, som håndterer den initiale udredning og behandling af pleurasygdom, forventes:
- at mestre fokuseret lunge-ultralydskanning (UL) [5]
- at kende guidelines (BTS eller DLS) [1, 4]
- at samarbejde og henvise til den regionale pleuraklinik.
Pleura er 0,3 mm tynd og beklæder ydersiden af lungen (pleura visceralis) og indersiden af thorax, mediastinum og diafragma (pleura parietalis). Pleura omkranser pleurahulen og indeholder få milliliter pleuravæske og et undertryk på –3 til –5 cmH2O betinget af modsatrettede kræfter i thoraxvæg og lunger. Begge pleurablade har få blodkar og mange smertenerver. Pleuravæske dannes og absorberes i pleura parietalis i en balance mellem både hydrostatiske og osmotiske trykforskelle mellem det systemiske kredsløb, lungekredsløbet og pleurahulen [6].
Absorptionen af pleuravæske kan øges med faktor 20, men kan alligevel overstiges af forskellige sygdomsprocesser, og de hyppigste årsager er hjertesvigt, inflammation og malignitet. Luft i pleurahulen absorberes ved simpel diffusion. Det immunologiske respons på f.eks. pleurainfektion er hæmmet af lav perfusion i et præformeret hulrum (pleurahulen).
Symptomer på pleurasygdom skyldes påvirkning af pleura, lunge og/eller thoraxvæg. Åndenød ved pleuraeffusion skyldes i mindre grad reduktion af lungevolumen og i højere grad væskens tyngde på diafragma, som både ændres fra kuppelform til flad og arbejder mod modstand [7]. Lindring ved pleuracentese skyldes derfor primært reetablering af diafragmafunktion.
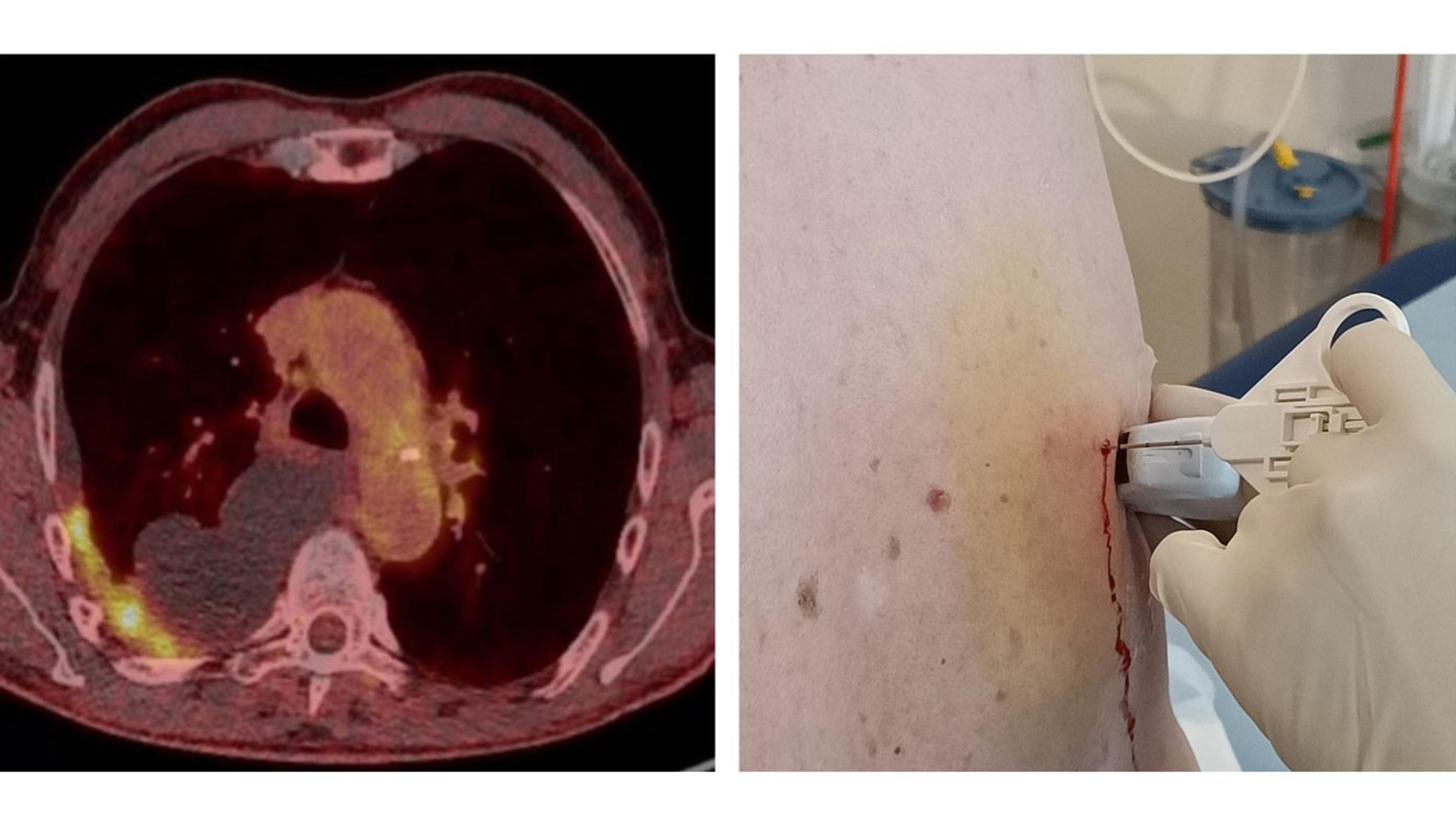
Pleuraeffusion påvises ved røntgenundersøgelse, UL, CT eller PET-CT af thorax (Figur 1). Med UL identificeres det optimale sted for prøvepunktur. Denne afklarer pleurainfektion (empyem, grumset væske (hvis klar væske: pH ≤ 7,2, men mindre sandsynligt ved pH > 7,2-< 7,4), dyrkning og resistens), cytologi (Tabel 1) samt ekssudativ (høj laktatdehydrogenasekoncentration (LDH) eller høj proteinkoncentration) versus transsudativ effusion (lav LDH og lav proteinkoncentration) [6] (Tabel 2). Hvis der er klar væske uden mistanke til pleurainfektion, kan større væskemængde udtømmes med lille pleuradræn (7-10 Fr), mens større dræn anlægges ved pleurainfektion (12-14 Fr) [1, 4].
Udredning
De fleste RCT’er inden for pleurasygdomme omhandler malign pleuraeffusion (MPE), som med eller uden pleurafortykkelse er den dominerende, kliniske manifestation af pleuramalignitet [8-12]. Den estimerede MPE-incidens er 70/100.000, dvs. i Danmark ca. 4.000/år, hvoraf knap 150 er primær pleuracancer (mesoteliom) [2].
Ved mistanke om MPE er udredning en specialistopgave, som varetages af pleuraklinikker i lungemedicinske centre med invasiv udredning og adgang til perkutane CT- eller UL-vejledte biopsier samt torakoskopi. Sensitivitet for pleuravæskecytologi er knap 50%, som varierer afhængig af underliggende cancerform. Guidelines anbefaler derfor invasiv udredning efter to cytologinegative pleuracenteser [1, 4].
Behandling
Pleuramalignitet er associeret med lav medianoverlevelse på blot fem måneder og lav livskvalitet [13]. Grundbehandling er systemisk anticancerterapi (SACT) og palliativ behandling i form af pleuracentese ved behov eller »definitiv pleurabehandling« som pleurodese (kemisk sammenlimning af pleura visceralis og pleura parietalis) eller tunneleret pleuradræn (permanent pleuradræn, indwelling pleural catheters (IPC)) [1, 4].
SACT har generelt begrænset effekt på MPE, fraset ved meget responsive cancerformer som højmaligne lymfomer og småcellet lungecancer [4]. Ved andre cancerformer vil fortsat dannes pleuravæske, og derfor anbefales definitiv pleurabehandling på diagnosetidspunktet til alle patienter med MPE, som ikke har SACT-responsive cancerformer [1, 4]. I Danmark dominerer dog fortsat watchful waiting med pleuracentese ved behov.
Hos patienter med MPE er IPC og pleurodese ligeværdige med henblik på lindring af symptomer [8]. IPC er associeret med færre indlæggelsesdage, men hyppigere pleurainfektion og knap 25% sandsynlighed for spontan pleurodese. Succesraten af talkumpleurodese er høj (75-80%), uanset om den udføres via dræn eller ved torakoskopi, og tidlig pleurodese er billigere end IPC, samtidig med at fremmedlegeme undgås [14]. Talkumpleurodese forudsætter dog lille væskeproduktion (< 150 ml/døgn) og kræver ca. tre dages indlæggelse [14]. BTS’ guidelines fra 2023 anbefaler, at talkumpleurodese allerede foretages i forbindelse med evt. diagnostisk torakoskopi. Dette er endnu ikke implementeret i Danmark.
IPC muliggør udtømninger af pleuravæske i eget hjem. Metoden foretrækkes ved stor væskeproduktion (> 150 ml/døgn) samt ved betydelig trapped lung, hvor fortykkelse af pleura visceralis forhindrer lungen i at ekspandere tilstrækkeligt til at muliggøre pleurodese. Almindeligvis tømmes 2-3 gange ugentligt, men daglig IPC-tømning fordobler sandsynligheden for spontan pleurodese [11], hvilket også ses ved talkumpleurodese via IPC [9, 15]. Denne kombination er ikke standard i Danmark.
Et pågående RCT fra Storbritannien undersøger effekten af torakoskopisk talkumpleurodese + IPC versus torakoskopisk talkumpleurodese alene [16].
Incidensen af pleuraeffusion i Danmark er ca. 250/100.000 svarende til godt 14.000/år, og mere end 60 forskellige årsager er identificeret [1]. Der kan være flere samtidige årsager. Da bilateral pleuraeffusion oftest er transsudativ og skyldes nonmaligne, ekstrapulmonale årsager (f.eks. hjertesvigt, nyresvigt og lavt niveau af plasmaalbumin), skelnes der i udredning mellem bilateral og unilateral pleuraeffusion. Ved bilateral pleuraeffusion med oplagt årsag kan analyse af pleuravæske udelades.
De fleste patienter har en let identificerbar årsag til pleuraeffusionen efter primær udredning med anamnese, pleuravæskeanalyser og røntgenundersøgelse af thorax. Såfremt årsagen fortsat er uklar, bør konfereres med lungemediciner. Videre udredning indebærer bl.a. CT af thorax, lunge-UL samt pleurabiopsier. Hvis den underliggende årsag ikke identificeres, iværksættes typisk et kontrolforløb med CT af thorax, idet 5% vil diagnosticeres med langsomt voksende malignitet inden for tre år, typisk mesoteliom [17].
Behandling af nonmalign pleuraeffusion
Behandling af nonmalign pleuraeffusion rettes mod den udløsende årsag samt palliation med pleuracentese. Evidensen for definitive pleurabehandlinger er begrænset [18]. Talkumpleurodese har lavere succesrate end ved MPE, og da det kliniske problem oftest er stor produktion af pleuravæske, er IPC typisk det eneste alternativ. I et mindre RCT (n = 68), som sammenlignede IPC og pleuracentese ved behov, sås ingen forskel i lindring af åndenød eller opnåelse af spontan pleurodese [19]. IPC er derfor fortsat eksperimentel behandling ved nonmalign pleuraeffusion, som kan bruges i udvalgte tilfælde [18].
Pleurainfektion dækker over kompliceret parapneumonisk pleuraeffusion (karakteriseret ved lav pH, lav glukosekoncentration, høj LDH samt evt. septa-/lommedannelse og påvisning af bakterier i pleuravæske) og empyem [1]. Op mod 57% af alle patienter med pneumoni har en simpel, parapneumonisk effusion, der ikke kræver anden behandling end pneumonibehandling og evt. terapeutisk pleuracentese [20]. Pleurainfektion kan udvikles ved direkte invasion fra pneumoni eller ved hæmatogen/lymfogen spredning. Pleurainfektion er associeret med høj mortalitet (etårsmortalitet: 15-20%) og langvarig indlæggelse (median: 13 dage) [21]. Tidlig diagnostik og opstart af intravenøs antibiotika- og specialiseret behandling forbedrer outcomes på både kort og langt sigt [21]. Specialiseret behandling er pleuradræn (12-14 Fr), som skylles med saltvand, samt – ved manglende respons efter 48 timer – intrapleural terapi med alteplase og DNase, der fremmer udtømningen af pleuravæske og forkorter indlæggelsestiden [22, 23].
Patienter med pleurainfektion bør behandles på specialiseret, lungemedicinsk afdeling. Ved manglende bedring 48 timer efter påbegyndt behandling bør patienten konfereres med thoraxkirurgisk afdeling med henblik på kikkertbaseret operation for at opnå infektionskontrol. Det pågående danske FIVERVATS-multicenterstudie afklarer, om tidlig kirurgi inden for 48 timer er bedre end intrapleural terapi [24].
Data fra Storbritannien viser en stigning i antal indlæggelser med spontan pneumothorax (fra 9,1/100.000 i 1968 til 14,1/100.000 i 2016) til dels drevet af genindlæggelser [25]. Der er derfor fokus på optimering af behandling inklusive forkortelse af indlæggelsestiden. Langt de fleste patienter, som indlægges med spontan pneumothorax, er klinisk stabile.
Der skelnes mellem primær (PSP) og sekundær spontan pneumothorax (SSP), hvor SSP defineres ved tilstedeværelse af kendt underliggende lungesygdom, og PSP defineres ved fraværet heraf.
For PSP er det nu muligt at tilbyde individualiseret behandling, som i modsætning til tidligere ikke afhænger af størrelsen af pneumothorax [1]:
Stabile patienter med lav symptombyrde gennem > 4 timer kan observeres uden dræn [26]. Et stort RCT viste, at dette var sikkert, dvs. uden dødsfald eller udvikling af trykpneumothorax. Overraskende så det ud til, at PSP-recidivraten var mindre hos dem, der ikke drænbehandledes [26].
Stabile patienter med symptomer kan behandles med smertestillende og ilt [26], aspiration [27] eller ambulant behandling med lille dræn med envejsventil [28] (f.eks. Heimlich-ventil eller Rocket Pleural Vent). Flere RCT’er har vist, at disse behandlinger er sikre.
Hvis ovenstående behandling svigter, lægges pleuradræn (10-12 Fr), som også er standardbehandling til ustabile patienter med PSP samt til alle symptomatiske patienter med SSP [1, 29].
Ambulant behandling bør derfor overvejes som førstevalg til behandling af PSP hos ressourcestærke patienter på afdelinger med den nødvendige ekspertise og mulighed for ambulant kontrol [1]. Dette setup er ikke standard i Danmark endnu.
Efterkontrol er afgørende ved PSP, idet spontan pneumothorax ikke optræder i raske lunger, men skyldes ikkediagnosticeret lungesygdom eller mikro- eller makroskopiske defekter i pleura visceralis. Rygestop for tobak og/eller cannabis halverer recidivrisiko. Derfor anbefales rygestop og højopløseligheds-CT af thorax til alle med PSP samt genetisk testning af særlige grupper med høj risiko for underliggende, betydende lungesygdom, såsom kvinder under 40 år eller ved familiær ophobning [1]. Ved bulløs lungesygdom eller ved gentagen PSP bør konfereres med thoraxkirurg med henblik på profylaktisk bullektomi eller pleurodese.
Incidensen af pleurasygdomme er stigende med høj mortalitet og morbiditet. Flere nye RCT’er har lagt fundamentet for evidensbaserede guidelines udgivet i 2023, som peger mod mere individualiseret og dermed specialiseret udredning og behandling. De fleste patienter med pleurasygdom indlægges via akutmodtagelser, men kan håndteres ambulant. Der er derfor behov for etablering af specialiserede, multidisciplinære, regionale pleuraklinikker for i fremtiden at kunne levere optimal, individualiseret, evidensbaseret behandling til det stigende antal borgere med pleurasygdom i Danmark.
For yderligere information om pleurasygdomme henvises til retningslinjerne på DLS’ hjemmeside.
Korrespondance Katrine Fjællegaard. E-mail: kafj@regionsjaelland.dk
Antaget 4. januar 2024
Publiceret på ugeskriftet.dk 1. april 2024
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V09230618
doi 10.61409/V09230618
Open Access under Creative Commons License CC BY-NC-ND 4.0
Katrine Fjællegaard, Jesper Koefod Petersen, Casper Jensen, Daniel Bech Rasmussen, Søren Helbo Skaarup, Christian B Laursen & Uffe Bødtger
Ugeskr Læger 2024;186:V09230618
The incidence of pleural disease is increasing and the mortality and morbidity is high. Many recent RCTs have resulted in evidence-based guidelines published in 2023, pointing towards a more individualized and specialized management. Most patients with pleural disease are admitted at the A & E but can be managed in outpatient clinics. Thus, there is a need to establish specialized, multidisciplinary pleural clinics to ensure optimal, individualized and evidence-based management of the increasing number of patients with pleural disease in Denmark, as argued in this review.